Terminata la Phase 2 per valutare ulteriormente l’immunogenicità e la sicurezza del CoronaVac, un vaccino per la SARS-CoV-2, responsabile del COVID-19. I risultati sono disponibili sul server di preprint medRxiv e dimostrano che il vaccino è ben tollerato e privo di significativi problemi di sicurezza correlati alla dose, il che apre la porta alla sperimentazione clinica di fase 3.
La pandemia mondiale del nuovo coronavirus, che ha messo letteralmente in ginocchio l’economia della maggior parte degli Stati a livello mondiale (in Italia ne sappiamo qualcosa…), e che nel momento in cui scrivo ha causato oltre 741.000 morti (qui i dati in tempo reale) ha scatenato una corsa contro il tempo, da parte di case farmaceutiche e istituzioni, al fine di trovare un vaccino contro il virus.
Al momento, Agosto 2020, esistono 231 vaccini candidati in fase di sviluppo e almeno 24 di loro sono passati agli studi clinici. Attualmente, ce ne sono 18 nella fase 1-2, mentre 6 stanno iniziando la fase 3.
Lo studio: “Immunogenicity and Safety of a SARS-CoV-2 Inactivated Vaccine in Healthy Adults Aged 18-59 years: Report of the Randomized, Double-blind, and Placebo-controlled Phase 2 Clinical Trial” è stato pubblicato su medRxiv il 10 Agosto 2020, e documenta la “fase 2” del vaccino CoronaVac, sviluppato dall’azienda biochimica cinese Sinovac Life Science Co. Ltd.
Come si è svolto
Lo studio (randomizzato, in doppio cieco, placebo controllato) è stato finalizzato a valutare il dosaggio ottimale, la sicurezza e l’immunogenicità del vaccino CoronaVac. Allo studio hanno preso parte un totale di 600 adulti sani di età compresa tra 18 e 59 anni.
I partecipanti sono stati assegnati in modo casuale in tre gruppi (rapporto di 2: 2: 1) per ricevere due iniezioni del vaccino testato a una dose di 3 μg / 0,5 mL, oppure 6 μg / 0,5 mL, oppure un placebo il giorno 0.
Per la valutazione della sicurezza, qualsiasi evento avverso è stato documentato dopo ciascuna vaccinazione rispettivamente entro 7 e 28 giorni. Gli eventi avversi immediati sono stati valutati anche in loco per almeno 30 minuti dopo ogni somministrazione di vaccino.
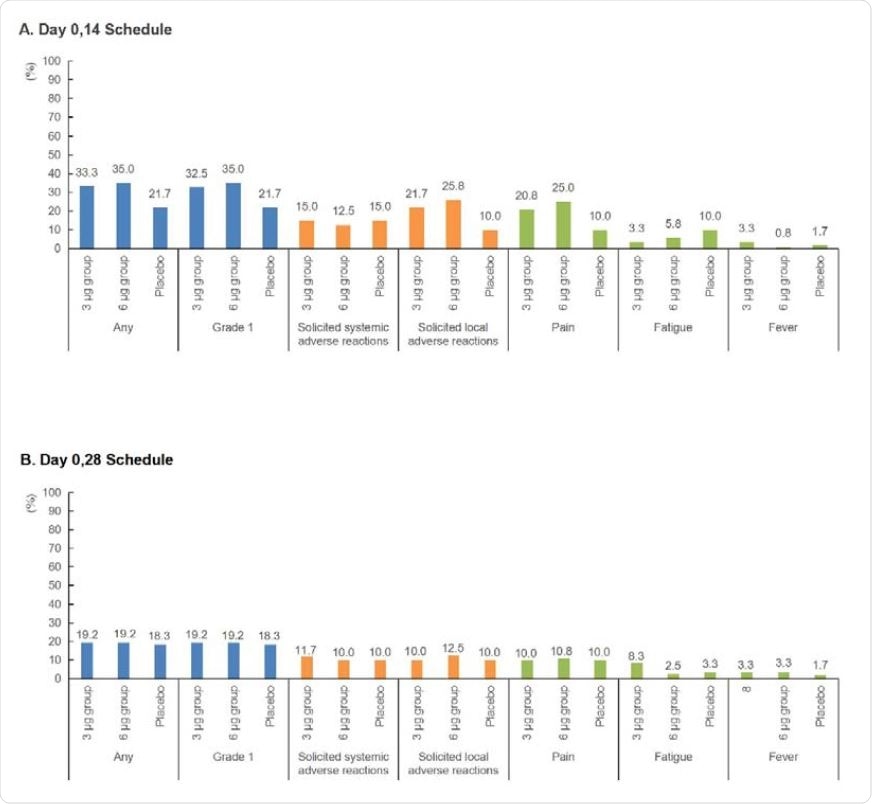
Lo studio ha dimostrato che entrambi i dosaggi di CoronaVac erano ben tollerati in adulti sani di età compresa tra 18 e 59 anni: i tassi di incidenza delle reazioni avverse nei gruppi da 6 μg e 3 μg erano comparabili, indice che non vi era alcuna dose-dipendenza con la maggiore o minore incidenza degli effetti collaterali (il più comune dei quali era il leggero dolore provato durante l’iniezione)
Importante fare menzione del fatto che l’analisi degli anticorpi sviluppati dai diversi gruppi vedeva notevoli differenze: gli anticorpi neutralizzanti erano significativamente inferiori con l’aumentare dell’età del volontario. Questi risultati sono coerenti con le tendenze epidemiologiche osservate nei pazienti con COVID-19.
Per la fase 3 i ricercatori affermano che consisterà in un trial di 28 giorni inoculando dosi da 3 μg di vaccino.